Beratung im Bereich Quality Management & Quality Systems
Eine unserer Dienstleistungen ist die Beratung und Unterstützung Ihres Unternehmes im Bereich Quality Management & Quality Systems. Wir beraten Sie diesbezüglich gerne bei der Erstellung und Pflege von Prozeduren und SOP´s für z.B. das Change Management, GxP-Prozeduren, CAPA Management, Dokumentenmanagement, Non-Conformity Management, SOP´s für die (Re-)Validierung & Qualifizierung Ihrer Prozesse und Testmethoden, das Risikomanagement und weiterer Prozeduren.
Wir beraten Sie selbstverständlich auch gerne zu generellen Fragen des Qualitätsmanagements und unterstützen Sie beim Aufbau eines Qualitätsmanagement- und/oder Dokumentenmanagementsystems gemäß ISO 13485.

Change Management
Änderungen von Prozeduren und Prozessen finden aufgrund des Bestrebens nach kontinuierlicher Verbesserung ständig statt und sind ein Kernelement des Qualitätsmanagements. Um die Auswirkungen von Änderungen vor der Implementierung beherrschen zu können, ist ein solides Change Management zwingend erforderlich. Wir beraten Sie bei der Erstellung und Pflege Ihres Change Management Systems und helfen bei der Optimierung der damit verbundenen Prozesse. Selbstverständlich unterstützen wir Sie auch gerne bei der Umsetzung von Änderungen und begleiten Sie bei der Planung und Bewertung der Änderung und potentieller Einflüsse, der Durchführung sowie bei der Entwicklung einer Implementierungs-strategie. Auch bei der Standardisierung und Harmonisierung Ihrer Prozeduren und Prozesse leisten wir gerne Unterstützung.

Dokumente & DMS
Ein weiteres Kernelement des Qualitätsmanagements stellen die Dokumente und das Dokumenten-managementsystem (DMS) dar. Für einen sicheren Überblick über die Vielzahl an SOP´s, Arbeitsanweisungen, Prüfplänen, Spezifikationen, usw., sowie deren Verknüpfungen, bildet ein gut strukturiertes Dokumentenmanagement-system das Fundament. Die Qualitätsaufzeichnungen (DHR) und Dokumentation zur Entwicklung (DHF) sowie die Risikomanagement-dokumentation (Risk Management File) sind ebenso wichtig. Gerne beraten und unterstützen wir Sie bei der Erstellung und Pflege Ihres Dokumentenmanagement-systems und halten Ihr Device Master Record (DMR) auf dem aktuellen Stand.

GMP, GDP, GLP & GxP
„Was nicht dokumentiert wurde, hat nicht stattgefunden.“ Dieser bekannte Leitsatz bringt gewisse Herausforderungen mit sich. Um den Anforderungen an der Art und Weise der Dokumentation gerecht zu werden, sind eindeutige Regeln für die Dokumente und Aufzeichnungen zu definieren. Zum Beispiel müssen alle Korrekturen an Dokumenten und Aufzeichnungen eindeutig nachvollziehbar und zuweisbar sein. Prozeduren zum Umgang mit Messabweichungen (OOS & OOT) helfen bei der der Auswertung, Trendermittlung und Entscheidungs-findung für potentielle Eskalationsschritte (NC, etc.). Arbeitsanweisungen zum Einschleusen von Material und Person in Reinräumen erhöhen die Produktsicherheit. Bei der Erstellung von GMP, GDP, GLP & GxP Prozeduren und den Umgang mit elektronischen Aufzeichnungen und Rohdaten (Data Integrity) beraten und unterstützen wir Sie gerne.

CAPA Management
Sie möchten Ihre CAPA-Prozedur optimieren? Wir unterstützen Sie bei der Umsetzung und Einbindung dieser Prozedur in Ihr QM-System und dem Change Management. Auch bei der Bearbeitung von CAPA´s unterstützen wir Sie gerne. Ob Fehleruntersuchungen, Ursachenanalysen, Trendermittlungen, Abgrenzungen, Definition von korrektiven und präventiven Maßnahmen sowie deren Umsetung oder der abschließenden Bewertung und Definition der Effektivitätskontrollen.

NC Management
Die Beratung und Unterstützung bei der Erstellung und Optimierung Ihrer Non-Conformity-Prozedur, inkl. der Erfassung und Beschreibung, Ursachenanalyse, Abgrenzung, Risikobewertung, Produktrisikoeskalation, Disposition, Maßnahmen zur Separation betroffener Produkte, der Sperrung der Produkte im Warenwirtschaftssystem oder das Erarbeiten und Umsetzen von Korrekturen und Korrekturmaßnahmen, gehören selbstverständlich auch zu den Leistungen, die wir Ihnen gerne anbieten.

Validierung im QM
Valide Herstellungsprozesse und Testmethoden sowie qualifiziertes Equipment bilden die Grundlagen bei der Fertigung qualitativ hochwertiger Produkte. Neben der Planung und Durchführung beraten wir Sie ebenfalls gerne bei der Erstellung und Pflege Ihrer Prozeduren für die Validierung & Qualifizierung oder Ihrer Validierungs-masterpläne und unterstützen Sie bei der Einbindung dieser Prozeduren in Ihr Qualitätsmanagementsystem sowie beim Change Management.
Beratung im Bereich Quality Assurance & Quality Control
Im Bereich Quality Assurance & Quality Control beraten und unterstützen wir Sie gerne bei der Erstellung und Pflege von Spezifikationen, Prüfplänen, Testmethoden, der Prüf- und Kalibriermittelüberwachung, Trendanalysen oder der Stichprobenplanung und deren Implementierung.
Wir freuen uns Ihnen auch bei der Bearbeitung von Non-Conformity-Berichten, inkl. der Untersuchung, Ursachenanalyse, Abgrenzung, Risikobewertung, Disposition sowie Erarbeiten und Umsetzung von Korrekturen und Korrekturmaßnahmen, tatkräftige Unterstützung anbieten zu können.


Beratung zur Thematik Validierung & Qualifizierung
Zu unseren Leistungen gehört die Beratung in allen Aspekten der Validierung Ihrer Produktionsprozesse, Reinigungsprozesse und Testmethoden sowie der Qualifizierung Ihrer Geräte und Anlagen. Neben der Beratung unterstützen wir Sie auch gerne aktiv bei der Planung und Umsetzung der Qualifizierung und Validierungen sowie der Erstellung der dazugehörigen Dokumentation. Selbstverständlich GDP-konform.

Qualifizierung von Geräten und Anlagen
Wir unterstützen Sie gerne bei der Erstellung der Qualifizierungs-dokumentation und der Planung und Umsetzung der Qualifizierungen Ihrer Geräte, Anlagen und Produktionslinien, Reinräumen, usw.
- Lastenhefte
- Pflichtenhefte
- Messmittel, Kalibrierungen
- Designqualifizierungen (DQ)
- Installationsqualifizierungen (IQ)
- Funktionsqualifizierungen (OQ)
- Leistungsqualifizierungen (PQ)
- Re-Qualifizierungen
- Qualifizierungskonzepte für Räume und Gebäude

Validierung von Herstellungsprozessen
Wir beraten und unterstützen Sie auch gerne bei der Erstellung der Validierungs-dokumentation und der Planung und Durchführung der Validierungen Ihrer Herstellungsprozesse.
- Prozessbeschreibungen
- Prozessrisikoanalysen (z.B. pFMEA)
- Validierungsstrategien und -ansätze
- Verifizierungen
- Kalibriermittel
- Messmittel, Kalibrierungen
- Akzeptanzkriterien
- Statistische Stichprobenplanung
- Funktionsqualifizierungen (OQ)
- Leistungsqualifizierungen (PQ)
- Re-Validierungen

Validierung von Reinigungsprozessen
Auch zu allen Fragestellungen in Bezug auf Reinigungsvalidierungen und deren Planung und Umsetzung beraten und unterstützen wir Sie gerne.
- Prozessbeschreibungen
- Prozessrisikoanalysen (z.B. pFMEA)
- Validierungsstrategien und -ansätze
- Messmittel, Kalibrierungen
- Akzeptanzkriterien
- Prozessüberwachungen
- Monitoring der Prozessmedien
- Funktionsqualifizierungen (OQ)
- Leistungsqualifizierungen (PQ)
- Re-Validierungen

Validierung von Testmethoden
Die Beratung bei der Planung und Umsetzung der Methodenvalidierung sowie zur Erstellung der Validierungs-dokumentation bieten wir Ihnen ebenso gerne an.
- Chemische, physikalische und organoleptische Methoden
- Attributive oder variable Methoden
- Methodenbeschreibungen
- Validierungsstrategien und -ansätze
- Messmittel, Kalibrierungen
- Messmittel und -überwachung
- Akzeptanzkriterien
- Statistische Stichprobenplanung
- Funktionsqualifizierungen (OQ)
- Leistungsqualifizierungen (PQ)
- Re-Validierungen
Monitoring
Das Thema Monitoring gehört auch zu unserem Beratungsportfolio. Ob die Erstellung von Monitoringplänen oder die Durchführung des Monitorings Ihrer Medien oder Umgebungsbedingungen.
- Monitoringstrategien und –ansätze
- Monitoring der Raumluft
- Monitoring von Reinstwasser
- Monitoring von Prozesswasser
- Monitoring der Prozessmedien
- Mess- und Kalibiermittel, Kalibrierungen
- Mess- und Kalibiermittelmittelüberwachung
- Akzeptanzkriterien
- Statistische Stichprobenplanung
- Monitoringbereiche

Nach der Validierung: Die Routineproduktion
Nach erfolgreichem Abschluss der Validierungen beraten wir Sie gerne in allen Aspekten der weiteren Prozess- und Qualitätskontrolle für Ihre Routine-produktion.
- Qualitätskontrolle
- Prüfpläne
- Messmittel, Kalibrierungspläne
- Messmittelüberwachung
- Akzeptanzkriterien
- Statistische Stichprobenpläne
- Change Management bei Prozessänderungen und der Beurteilung.
- Re-Validierungen
- Verifizierungen
- usw.
Beratung zur Thematik Softwarevalidierung und Part 11
Auch in der Thematik Softwarevalidierung bzw. Computersystemvalidierung (CSV) beraten und unterstützen wir Sie gerne aktiv bei der Planung und Umsetzung der Validierungen Ihrer Software oder Applikationen gemäß ISO 13485, IEC 62304 und FDA 21 CFR Part 820.
Selbstverständlich unterstützen wir Sie auch in Bezug auf Fragestellungen zur 21 CFR Part 11 Compliance für elektronische Aufzeichnungen und den Umgang mit Rohdaten (Data Integrity).


Beratung im Risikomanagement
Sie benötigen sachkundige Unterstützung im Risikomanagement oder bei der Erstellung Ihrer Risiko-managementdokumentation? Das Risikomanagement steht im Mittelpunkt der Medizinprodukte- und Arzneimittelherstellung. Ein fundiertes Risikomanagement senkt die Risiken für Patienten und Anwender sowie die unternehmerischen Risiken, die mit Qualitätsereignissen einhergehen können. Lassen Sie sich bei der Erstellung oder Pflege Ihres Risikomanagements von uns beraten und unterstützen.
Wir beraten Sie selbstverständlich auch gerne zu generellen Fragen des Risikomanagements und unterstützen Sie beim Aufbau eines eine Risikomanagements gemäß ISO 14971.

Risk Management Process
Wir begleiten Sie bei der Erstellung und Pflege Ihres Risikomanagementssystems und der Risk Management Files.
- Risk Analysis
- Risk Evaluation
- Risk Control
- Risk Management Plan
- Risk Management Review
- Production and Post-Production Activities
- usw.
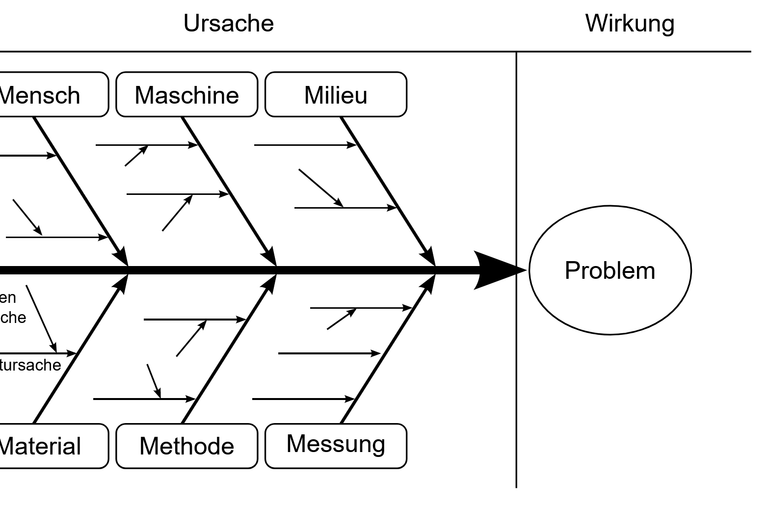
Process & Product Risk Assessment
Die Identifizierung und Minimierung von Prozess- und Produktrisiken ist elementar Schritt bei der Entwicklung und Produktion von Medizinprodukten. Selbst die Anwendung von Software kann mit Risiken einhergehen.
- FMEA
- Ishikawa-Diagram
- Fault Tree Analysis
- Cause and Effect Analysis
- usw.
Process & Product Risk Escalation
Wir helfen Ihnen bei der Gestaltung Ihrer Risikoeskaltionsprozesse, damit Sie schnell und angemessen auf jede Situation reagieren können.
- Near Miss
- Process and Product Issue Assessment
- Process and Product Issue Escalation
- Quality Review Board
- usw.
